HUBUNGAN ANTARA ADVANCED GLYCATION END PRODUCTS (AGEs) DAN INFLAMASI VASKULAR DENGAN PERCEPATAN PROSES ATEROSKLEROSIS PADA PENDERITA DIABETES MELITUS
BAB I
PENDAHULUAN
1.1
Latar
Belakang
Penyakit kardiovaskuler merupakan penyebab kematian
nomor satu di dunia untuk saat ini. Pada tahun 2008 sedikitnya
17, 3 juta jiwa atau 30% kematian seluruh dunia disebabkan oleh penyakit
kardiovaskuler (WHO, 2011), diantaranya ± 7,25 juta jiwa disebabkan oleh
penyakit jantung koroner (PJK) dan ± 6,15 juta jiwa oleh stroke dan penyakit
serebrovaskuler yang lain (WHO, 2008). Penyakit jantung koroner dan penyakit
serebrovaskuler ini diantaranya disebabkan oleh adanya proses arterosklerosis
(Waller, 2010).
Saat
ini diketahui bahwa aterosklerosis merupakan respon
inflamasi kronis terhadap cedera pembuluh darah akibat dari berbagai sebab yang
mengaktivasi atau mencederai endotel (Hansson, 2005; Libby 2002; Nilsson,2005).
Diabetes
mellitus merupakan suatu kelompok penyakit metabolik dengan karakteristik
hiperglikemia. Berbagai penelitian epidemiologi menunjukkan adanya
kecenderungan peningkatan angka insidensi dan prevalensi DM tipe 2 diberbagai
penjuru dunia. Di indonesia WHO memprediksi
kenaikan jumlah penyandang DM dari 8,4
juta pada tahun 2000 menjadi sekitar 21,3 juta pada tahun 2030 (PERKENI, 2011)
Penyebab
kematian dan kesakitan utama pada penderita diabetes (baik DM tipe 1 maupun DM
tipe 2) adalah penyakit kardiovaskuler. Penyulit mikroangiopati pada diabetes
bermanifestasi sebagai arterosklerosis dini yang dapat mengenai organ-organ
vital (jantung dan otak). Penyebab aterosklerosis pada penderita DM tipe 2
bersifat multifaktorial yang melibatkan interaksi kompleks dari berbagai
keadaan seperti hiperglikemia, hiperlipidemia, stress oksidatif, penuaan dini,
hiperinsulinemia serta perubahan-perubahan dalam proses koagulasi dan
fibrinolisis (ADA, 2012; Hayat et al, 2004).
Hipotesis
terbaru mengatakan bahwa awal terjadinya lesi aterosklerosis yaitu berupa
adanya perubahan fungsi endotel. Disfungsi endotel dapat terjadi baik pada
penderita tipe 2 dan juga pada penderita DM tipe 1 terutama bila telah terjadi
manifestasi klinis mikroalbuminuria. Disfungsi endotel juga dapat terjadi pada
individu dengan resistensi insulin (pasien obese) atau yang mempunyai resiko
tinggi untuk menderita DM tipe 2 (toleransi glukosa terganggu) dan penderita
diabetes gestasi. Dalam beberapa tahun terakhir ini diketahui bahwa diabetes
dapat mempengaruhi otot jantung secara independen selain melalui keterlibatan
arterosklerosis dini arteri koroner yang menyebabkan penyakit jantung iskemik
(ADA, 2012; Hayat et al, 2004).
Meskipun efek dari glukosa yang menimbulkan efek yang merugikan bagi
seluler terjadi melalui berbagai mekanisme, namun jalur yang terpenting dalam
patogenesis percepatan aterosklerosis pada diabetes adalah peningkatan reaksi
glikasi non-enzimatik dari protein dan lipid yang ireversibel yang disebut
dengan advanced glycation end products
(AGEs) (Basta et al, 2004)
1.2 Tujuan Penulisan
Penulisan makalah bertujuan untuk mengetahui hubungan antara advanced glycation end products (AGEs) dan
inflamasi vaskular dengan percepatan proses aterosklerosis pada penderita
diabetes melitus.
BAB II
TINJAUAN PUSTAKA
2.1 Aterosklerosis
Aterosklerosis
merupakan penebalan dan pengerasan arteri akibat terbentuknya plak yang
tersusun dari sekumpulan lipoprotein, matriks ekstrasel seperti kolagen,
proteoglikan dan glikosaminoglikan, kalsium, sel-sel otot polos, pembuluh darah
baru. sel-sel radang terutama makrofag, limfosit T, mastosit dan sel dendritik (Vuster, 2007; Falk, 2012) Aterosklerosis dapat terjadi pada
seluruh arteri, sehingga manifestasi klinis yang muncul tergantung pada sistem
organ yang terkena. Pada sistem saraf
pusat menimbulkan stroke, pada sirkulasi perifer menyababkan klaudikasio
intermiten, pada sirkulasi splanknik menimbulkan iskemia mesenterika dan pada
arteri koroner menyebabkan penyakit jantung koroner (PJK) yang menimbulkan
infark miokard dan angina pectoris (Libby, 2008).
Pada saat ini diketahui bahwa aterosklerosis merupakan
respon inflamasi kronis terhadap cedera pembuluh darah akibat dari berbagai
sebab yang mengaktivasi atau mencederai endotel (Albertini et al, 2008). Arteri
normal merupakan bentukan menyerupai tabung dengan bagian dalam yang tersusun
dari lapisan endotel yang befungsi sebagai komponen antitrombotik dengan cara
menghalangi makrofag yang beredar didalam aliran darah memasuki dinding
pembuluh darah. Selain itu lapisan endotel juga merupakan organ autokrin dan
parakrin yang mensintesa zat-zat anti peradangan, menjalankan fungsi mitogenik,
kontraktil dan proses hemostasis. Nitric
oxide (NO) merupakan salah satu zat yang bertanggungjawab dalam proses
aterosklerosis. Disfungi endotel merupakan titik awal terjadinya
aterosklerosis. Disfungsi endotel, yang lebih tepatnya dapat dikatakan sebagai
aktivasi endotel merupakan proses yang merupakan serentetan kejadian proses
properadangan, proliferasi dan prokoagulasi,
ditandai dengan turunnya sintesa NO, sehingga menyebabkan lipoprotein
dan monosit lebih mudah menembus dinding pembuluh darah yang kemudian akan
mengalami oksidasi dan akumulasi di intima, proliferasi sel otot polos pembuluh
darah, penimbunan matriks ekstraseluler dan konstriksi pembuluh darah (Vuster, 2007).
Hiperkolesterolemia
memicu terjadinya akumulasi lipoprotein berdensitas rendah atau Low Density Lipoprotein (LDL) pada
lapisan intima pembuluh darah. Partikel lipoprotein ini biasanya bergabung
dengan matriks ekstraseluler pembuluh darah, terutama proteoglikan. Keluarnya
lipoprotein ini dari aliran darah mengakibatkan lipoprotein terpisah dari zat-zat
antioksidan di dalam plasma, sehingga mempermudah terjadinya proses modifikasi
oksidatif. Lipoprotein yang teroksidasi ini dapat memicu terjadinya respon
peradangan lokal sebagai akibat dari masuknya lipoprotein ke dalam dinding
pembuluh darah, NF-kB dan Chemothactic
Adhesion Molecule (CAM) akan teraktivasi sehingga aktivasi kedua zat ini
akan mempermudah perlekatan pada reseptor adesi dan penembusan makrofag dan
limfosit ke dinding pembuluh darah. Akumulasi lekosit ini merupakan
karakteristik awal terbentuknya lesi aterosklerosis pada pembuluh darah. Jadi,
proses peradangan sudah terlibat dalam proses pembentukan aterosklerosis sejak
awal. Setelah menembus endotel makrofag dan limfosit akan bergerak menuju
lapisan intima pembuluh darah. Pergerakan ini diduga tergantung pada adanya
faktor-faktor chemoattractant
meliputi partikel lipoprotein yang terksidasi dan sitokin sel peradangan
misalnya interleukin -1 (IL-1) dan tumor
necrosing factor (TNF-), chemokine
macrophage chemoattractant protein-1 yang diproduksi oleh sel-sel dinding
pembuluh darah sebagai respon terhadap adanya lipoprotein yang teroksidasi. Terdapat
beberapa faktor peradangan yang terlibat dalam proses pembentukan
ateroskleosis, seperti CRP, fibrinogen, IL-1b, IL-6 dan TNF-α. Sedangkan
ekspresi E-Selectin dan VCAM-1 merupakan petanda awal terjadinya disfungsi
endotel (Vuster, 2007; Libby, 2008).
Lekosit-lekosit
ini dapat membelah diri dan memperbesar respon peradangan yang terjadi.
Makrofag yang terdapat pada lesi ini kemudian akan memakan lemak yang terdapat
pada lipoprotein sehingga sitoplasmanya berisi butir-butir lemak. Bentukan ini
disebut dengan sel busa. Proses ini kemudian akan diikuti dengan migrasi
sel-sel otot polos dari tunika media pembuluh darah menuju tunika intima dan
berakumulasi disana, sehingga memperbesar lesi yang terbentuk (Libby, 2008).
Gambar 1. Proses pembentukan
aterosklerosis (dikutip dari Cefalu, 2006)
Saat
ini diketahui bahwa aterosklerosis merupakan respon peradangan kronis terhadap
kerusakan pembuluh darah akibat berbagai sebab yang mengaktivasi atau merusak
endotel. Hal ini didasarkan pada hasil dari beberapa penelitian pada berbagai
populasi yang menunjukkan bahwa terdapat hubungan antara kadar berbagai petanda
peradangan, terutama C-reactive Protein (CRP).
Risiko untuk mengalami kejadian klinis lebih tinggi pada pasien dengan
peningkatan kadar CRP dan petanda peradangan yang lain misalnya ICAM-1, VCAM-1,
E-selectin dan IL-6. Hasil dari berbagai penelitian ini kemudian menimbulkan
dua pemikiran, yang pertama adalah bahwa aterosklerosis terjadi sebagai akibat
dari adanya peradangan kronis dan yang kedua adalah sebaliknya, bahwa
peradangan muncul akibat adanya aterosklerosis (Rudd et
al, 2007).
Pada penderita Diabetes melitus (DM) terjadi percepatan
proses aterosklerosis yang secara garis besar diterangkan pada gambar 2. Perbandingan
aterektomi koroner pada subyek nondiabetik dan diabetik terjadi peningkatan
prosentase dari total area yang ditempati oleh jaringan lipid-rich
atheromatous dari 2%±1% ke 7%±2% (p=0.01) dan peningkatan insiden
thrombus dari 40% ke 62% (p=0.04) untuk nondiabetik dan diabetik.
Infiltrasi Makrofag meningkat mendekati 2 kali (p=0.003) pada subyek
diabetik (Feener dan Dzau, 2006).
Gambar 2. Efek aterogenik pada diabetes ( dikutip
dari Feener dan Dzau, 2006).
2.2 Diabetes Melitus
Diabetes melitus (DM) merupakan golongan penyakit metabolik yang ditandai dengan gangguan hiperglikemia kronik
disertai kelainan metabolik akibat gangguan sekresi insulin,
kerja insulin atau kombinasinya yang menimbulkan berbagai
komplikasi kronis pada mata, ginjal saraf dan pembuluh darah. Gangguan regulasi
metabolik pada DM menyebabkan perubahan fisiologi pada berbagai sistem organ. Gejala
umum atau klasik adalah poliuria (sering
kencing), polidipsia (rasa haus yang terus-menerus), kehilangan berat badan dan
kadang-kadang polifagia (perasaan lapar yang berlebih). Kriteria diagnosis
diabetes melitus dapat dilihat pada Tabel 1 (ADA, 2012).
Tabel 1. Kriteria Diagnosis Diabetes Melitus
|
HbA1c ≥ 6,5 %
|
Atau
|
Gula darah puasa ≥
126 mg/dL. Puasa: tidak mengkonsumsi sumber kalori paling tidak selama 8 jam
|
Atau
|
Gula darah 2 jam ≥
200 mg/dL pada uji toleransi gula secara oral
Tes toleransi glukosa
oral (TTGO) yaitu pengujian 75 g glukosa anhidrat yang dilarutkan dalam air
|
Atau
|
Gejala klasik dari
hiperglikemia atau krisis hiperglikemia dengan konsentrasi glukosa darah acak
≥ 200 mg/dL
|
2.3 Respon Inflamasi pada Penderita DM
Peradangan
atau inflamasi terlibat pada semua tahap pembentukan aterosklerosis dan sudah
diketahui sejak lama bahwa diabetes mellitus tipe 2 merupakan penyakit
peradangan yang melibatkan respon peradangan tipe cepat yang dimediasi oleh
sitokin. Pada diabetes mellitus tipe 2 terjadi
pembentukan aerosklerosis yang cepat, diduga karena adanya pembentukan
dan deposisi molekul advanced glycation
end products (AGEs) yang merupakan hasil dari glikasi protein dan gula atau
lipid akibat peningkatan kadar glukosa darah.
Reseptor AGE (RAGE) diekspresikan
pada berbagai organ dan sel, termasuk sel endotel, sel otot polos vaskuler dan
makrofag. Ikatan AGEs pada RAGE memicu pembentukan reactive oxygen species (ROS) intraseluler,
yang selanjutnya akan mengaktivasi NF-κB, sehingga ekspresi berbagi sitokin
juga akan meningkat, meliputi tumour necrosis factors (TNF-α dan TNF-β),
interleukins (IL) 1, 6, 8 dan18 dan interferon-γ (Wright,
2006).
Peradangan
yang terjadi setelah peningkatan akut glukosa darah ditandai dengan
meningkatnya berbagai petanda peradangan, seperti high sensitivity C Reactive Protein (hs-CRP), Interleukin-6 (IL-6), Tumor Necrosis
Factor-α (TNF- α) dan Interleukin-18 (IL-18). Ekspresi β2-integrin Mac-1 pada
netrofil juga diketahui mengalami peningkatan pada menit ke 120 setelah
pemberian beban glukosa oral 75 gram, baik pada subyek normal, gangguan
toleransi glukosa maupun yang sudah diketahui menderita diabetes. Penelitian
lain menemukan bahwa setelah pemberian beban glukosa oral 75 gram
sitokin-sitokin proinflamasi mencapai kadar puncaknya setelah 90 menit, yang
pada subyek normal kadarnya kembali normal setelah 2 jam pemberian beban. Namun
pada subyek dengan sindroma metabolik kadar TNF-α, ICAm-1 dan IL-6 masih
meningkat secara signifikan (Node, K dan
Inoue T, 2009).
Berbagai
penelitian menunjukkan bahwa hiperglikemi akut meningkatkan risiko
kardiovaskular melalui berbagai mekanisme pada tingkat jaringan, sel dan
biokimia, menimbulkan stres oksidatif sehingga mengaktivasi protein kinase-C (PKC), reseptor advanced glycated
end product (RAGE), sehingga menyebabkan vasokonstriksi, aktivasi respon
peradangan dan trombosis. Peradangan
berperan penting dalam patogenesis PJK, dalam progresivitas pembentukan plak,
maupun dalam proses ruptur plak dan pembentukan trombus. Proses peradangan
dapat dianggap sebagai jembatan antara anterosklerosis dan trombosis. Pada
kondisi normal, endotel mempunyai mekanisme antiaterogenesis dengan cara
mensekresikan anitrombotik dan substansi vasoaktif. Apabila terjadi disfungsi
endotel maka sekresi substansi-substansi-substansi ini berkurang, sehingga
meningkatkan permeabilitas lipid yang beredar di sirkulasi untuk menembus ruang
subendotel, ditambah dengan meningkatnya ekspresi protein-protein adesif dari
golongan selektin, maka monosit dan T limfosit yang beredar di sirkulasi juga
mudah menembus endotel ke ruang subendotel. Respon peradangan yang
berkelanjutan menstimulasi migrasi dan proliferasi sel otot polos yang
terakumulasi di sekitar area peradangan sehigga menyebabkan penebalan dinding
arteri, selain itu respon peradangan juga meningkatkan transfer lipoprotein
melalui endotel (Maroon et al, 2012)
Sebagai
respon dari aktivasi berbagai sitokin pada respon peradangan seperti IL-1 dan
IL-6, hepatosit memproduksi C-Reaktif Protein (CRP). CRP ini kemudian dapat
meningkatkan ekspresi molekul adesi, meningkatkan ekspresi palsminogen
activator inhibitor 1, menurunkan bioavailabilitas nitric
oxide (NO) dan meningkatkan pengambilan Low-density lipoprotein oleh makrofag.
Pada plak ateroma CRP dapat ditemukan pada cap
plak dengan cara pengecatan imunohistokimia, sehingga semakin mengeaskan konsep
bahwa peradangan berperan penting dalam pembentukan plak dan instabilitasnya (Klein, 2007)
2.4
Disfungsi Endotel pada Pasien DM
Disfungsi endotel pada pasien DM
berhubungan dengan resistensi insulin, menunjukkan peranannya sebagai penyebab
awal perkembangan terjadinya aterosklerosis (early atherosclerotic cardiovascular disease). Adanya disfungsi
endotel dapat diukur dengan mendeteksi kadar endhotelial soluble adhesion molecules di sirkulasi darah.
Rangsangan proinflamasi tertentu dapat menimbulkan ekspresi molekul-molekul
adhesi seperti E-Selectin, intercellular
adhesion molecule-1 (ICAM-1), dan vascular
cell adhesionmolecules-1 (VCAM-1) pada permukaan sel-sel endotel (Song et al, 2007). ICAM-1
dan VCAM-1 berhubungan dengan molekul yang termasuk dalam golongan
imunoglobulin. Molekul-molekul ini merupakan ligand untuk integritas leukosit
dan digunakan untuk menstabilisasi perlekatan leukosit pada dinding endotel dan
terlibat dalam interaksi seluler di jaringan (Albertini et al, 2008)
VCAM-1 diduga hanya diekspresikan di
dalam sel-sel endotel, tetapi ternyata juga ditemukan pada sel-sel dendritik,
makrofag jaringan, dan sel-sel epitel tubulus ginjal. Disisi lain, E-Selectin
(CD62E) hanya ditemukan pada sel endotel yang teraktivasi, sehingga hal ini
berbeda dengan molekul adhesi yang lain. Sel endotel melepaskan E-Selectin
setelah terjadinya aktivasi invitro. Interaksi antara E-Selectin dan VCAM-1
beserta ligand-ligandnya mendasari perpindahan sel-sel leukosit pada dinding
pembuluh darah yang mengalami proses inflamasi (Albertini et al, 2008; Song et al, 2007).
Bentuk
terlarut dari E-Selectin dan VCAM-1 dapat ditemukan dalam darah orang normal.
Beberapa dari marker ini meningkat secara signifikan pada pasien-pasien yang
mengalami suatu inflamasi, seperti pada penyakit diabetes melitus (DM) dan
keganasan. Aktivasi jalur AGEs (Advance
Glycation End Products) pada DM telah menunjukkan terjadinya peningkatan
ekspresi E-Selectin dan VCAM-1 (Albertini et al, 2008).
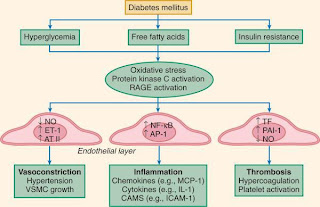
Hiperglikemi,
peningkatan asam lemak bebas, dislipidemi, dan resistensi insulin yang akan
meningkatkan produksi ROS, AGEs, dan mengaktifasi
protein kinase C (PKC), menurunkan bioavailabilitas dari NO dan
menurunkan potensi vasodilatasi, antiinflamasi, dan efek antitrombotik.
Sehingga terjadi penurunan fungsi endotel dan vasokonstriksi, inflamasi, dan
trombosis. Penurunan NO dan peningkatan endothelin-1 (ET-1) dan konsentrasi
angiotensin II (AT II) akan meningkatkan permeabilitas
vaskuler dan terjadi pertumbuhan dan migrasi sel otot polos vaskuler (Gambar 3).
Gambar 3. Disfungsi
endotel pada diabetes mellitus (dikutip dari Beckman et al., 2012).
Aktivasi
dari transkripsi nuclear factor-kB (NF-kB) dan activator protein-1 (AP-1)
memicu pengeluaran dari leukocyte-attracting chemokines, produksi
sitokin inflamasi, dan ekspresi cell adhesion molecules. Penurunan NO
dan prostasiklin mengaktifkan platelet bersamaan
dengan peningkatan plasmin activator inhibitor-1 (PAI-1) dan tissue
factor (TF) sehingga terjadi keadaan protrombotik (Beckman et al.,
2012). Interaksi dari
AGEs dengan makrofag memicu dikeluarkannya platelet-derived growth factor (PDGF),
insulin-like growth factor-1 (IGF-1), dan sitokin proinflamasi seperti
IL-1β and TNF-α (Basta et al.,2004).
Disfungsi
endotel yang mengawali lesi aterosklerosis pada penderita diabetes mellitus dapat terjadi akibat :
1.
Hiperglikemi
Hiperglikemi
kronik menyebabkan disfungsi endotel melalui berbagai mekanisme antara lain (Beckman
et al., 2012; Makimattila et al, 1996):
a.
Hiperglikemi kronik yang menyebabkan glikosilasi non
enzimatik dari protein dan makromolekul seperti DNA, yang akan mengakibatkan
perubahan sifat antigenik dari protein dan DNA. Keadaan ini akan menyebabkan
perubahan tekanan intravaskuler dan mengganggu reaktivitas serebrovaskuler
akibat gangguan NO dan prostaglandin
b.
Hiperglikemi meningkatkan aktivasi PKC intraseluler sehingga akan menyebabkan gangguan NADPH pool yang akan menghambat produksi NO.
c.
Over ekspresi
growth factors meningkatkan
proliferasi sel endotel dan otot polos pembuluh darah sehingga akan
terjadi neovaskularisasi.
d.
Hiperglikemi akan meningkatkan sintesis diacylglyerol (DAG) melalui
jalur glikolitik. Peningkatan kadar DAG akan meningkatkan aktivitas PKC. Baik DAG maupun PKC berperan dalam memodulasi terjadinya vasokonstriksi.
e.
Sel endotel sangat peka terhadap pengaruh stres oksidatif. Keadaan hiperglikemi akan meningkatkan tendensi untuk terjadinya
stres oksidatif dan peningkatan oxidized lipoprotein, terutama small dense LDL cholesterol (oxidized LDL) yang lebih bersifat aterogenik. Peningkatan kadar asam lemak bebas dan keadaan hiperglikemi dapat meningkatkan oksidasi fosfolipid dan protein.
f.
Hiperglikemi akan disertai dengan tendensi protrombik dan
agregasi platelet. Keadaan ini berhubungan dengan beberapa faktor antara lain
penurunan produksi NO dan penurunan aktivitas fibrinolitik akibat peningkatan
kadar PAI-1. Disamping itu DM tipe 2 terjadi peningkatan aktivitas koagulasi
akibat pengaruh berbagai faktor seperti pembentukan advanced glycation end products (AGEs) dan penurunan sintesis heparinsulfat.
g.
Walaupun tidak ada hubungan langsung
antara aktivasi koagulasi dengan disfungsi endotel, namun aktivasi koagulasi yang berulang dapat
menyebabkan overstimulasi dari sel-sel endotel sehingga akan terjadi disfungsi endotel
2. Resistensi insulin
Beberapa
tahun yang lalu, Jialal dan kawan-kawan menemukan adanya reseptor terhadap insulin
yaitu IGF-I dan IGF-II pada sel-sel dari pembuluh darah besar dan kecil dengan karakteristik ikatan yang sama
dengan yang ada pada sel-sel lain. Para peneliti ini menyatakan
bahwa reseptor IGF-I dan IGF-II pada sel endotel terbukti
berperan secara fisiologik dalam
komplikasi vaskuler yang terjadi pada diabetes (Jialal et al, 1985).
Defisiensi
insulin dan hiperglikemi kronik dapat meningkatkan kadar total proteinkinase C
(PKC) dan diacylglycerol
(DAG). Insulin mempunyai efek langsung pada jaringan pembuluh darah.
Pada penelitian terhadap jaringan pembuluh darah dari obese Zucker rat didapatkan adanya
resistensi terhadap sinyal PI3-kinase. Temuan ini membuktikan bahwa resistensi insulin akan menimbulkan gangguan langsung pada fungsi pembuluh darah (Jiang et al,
1999).
3. Hiperamilinemi
Amilin
atau disebut juga Islet
Amyloid Polypeptide (IAPP) merupakan
polipeptida yang mempunyai 37
gugus asam amino, disintesis dan disekresi oleh sel-sel beta pankreas bersama-sama dengan insulin. Jadi keadaan hiperinsulinemi akan disertai dengan hiperamilinemi
dan sebaliknya bila terjadi penurunan kadar insulin akan disertai pula dengan
hipoamilinemi. Hiperinsulinemi dan hiperamilinemi dapat menyertai keadaan resistensi insulin / sindrom metabolik dan DM tipe 2. Terjadinya amiloidosis (penumpukan endapan amilin) didalam islet diduga berhubungan dengan lama dan beratnya
resistensi insulin dan DM tipe 2. Sebaliknya , penumpukan endapan amilin didalam sel-sel beta pankreas akan
menurunkan fungsinya dalam mensekresi insulin. Sakuraba
dan kawan-kawan baru-baru ini mendapatkan bahwa pada penderita DM tipe
2, peningkatan stress oksidatif berhubungan dengan peningkatan pembentukan IAPP didalam sel-sel beta pancreas.
Dalam keadaan ini terjadi penurunan ekspresi
SOD yang menyertai pembentukan IAPP
dan penurunan massa sel beta. Temuan ini menunjukkan adanya hubungan antara terjadinya stress oksidatif dengan pembentukan IAPP, penurunan massa dan densitas sel-sel
beta pancreas. Amilin juga dapat merangsang lipolisis
dan merupakan salah satu mediator terjadinya resistensi insulin. Baru-baru
ini ditemukan pula amylin binding site didalam korteks ginjal, dimana amilin dapat mengaktivasi RAAS dengan akibat
terjadinya peningkatan kadar rennin dan aldosterone. Janson
dan kawan-kawan mendapatkan adanya partikel2 amyloid (intermediate
sized toxic amyloid particles = ISTAPs) yang
bersifat sitotoksik terhadap sel-sel beta pancreas yang
dapat mengakibatkan apoptosis dengan cara merusak membran sel (Hayden et al, 2001).
4.
Inflamasi
Dalam
beberapa tahun terakhir , terbukti bahwa inflamasi tidak hanya menimbulkan komplikasi penyakit kardiovaskuler akut,
tetapi juga merupakan penyebab utama dalam proses terjadi dan progresivitas aterosklerosis. Berbagai pertanda inflamasi telah ditemukan didalam lesi aterosklerosis, antara lain sitokin dan growth factors yang dilepaskan
oleh makrofag dan T cells. Sitokin akan meningkatkan sintesis Platelet activating Factor, merangsang lipolisis, ekspresi molekul-molekul
adhesi dan up regulasi sintesis serta ekspresi
aktivitas prokoagulan didalam sel-sel endotel (Albertini et al,
2008; Song et al, 2007).
5.
Trombosis / Fibrinolisis
Diabetes akan disertai dengan keadaan protrombotik yaitu perubahan-perubahan proses trombosis dan fibrinolisis. Kelainan ini disebabkan karena adanya resistensi insulin
terutama yang terjadi pada penderita DM tipe 2. Walaupun demikian dapat pula ditemukan pada penderita DM tipe
1. Peningkatan fibrinogen serta aktivitas factor VII dan PAI-1 baik didalam plasma maupun
didalam plak aterosklerotik akan menyebabkan penurunan urokinase dan meningkatkan aggregasi platelet. Penyebab peningkatan fibrinogen diduga karena meningkatnya
aktivitas factor VII yang berhubungan dengan terjadinya
hiperlipidemi post prandial. Over ekspresi PAI-1 diduga
terjadi akibat efek langsung dari insulin dan pro insulin. Penelitian terbaru menunjukkan
bahwa penurunan kadar PAI-1 setelah pengobatan DM tipe 2 dengan thiazolidinediones menyokong hipotesis
adanya peranan resistensi insulin dalam proses terjadinya over ekspresi
PAI-1.Peningkatan PAI-1 baik didalam plasma maupun didalam plak aterosklerosis
tidak hanya menghambat migrasi sel otot
polos pembuluh darah, melainkan juga disertai penurunan ekspresi urokinase didalam dinding
pembuluh darah dan plak aterosklerosis. Terjadinya proteolisis pada daerah
fibrous cap dari plak yang
menunjukkan peningkatan aktivasi sel T dan
makrofag akan memicu terjadinya ruptur plak dengan akibat terjadinya sindrom koroner akut. Mekanisme yang mendasari terjadinya keadaan hiperkoagulasi pada penderita
diabetes dan resistensi insulin, masih dalam penelitian lebih lanjut (Nordt et al, 1993).
6.
Dislipidemia
Dislipidemia
yang akan menimbulkan stress oksidatif umum terjadi pada resistensi nsulin/sindrom metabolik dan DM tipe 2. Keadaan ini terjadi akibat gangguan metabolisme lipoprotein yang sering
disebut sebagai "lipid triad", meliputi :
a.
Peningkatan kadar VLDL atau trigliserida
b.
Penurunan kadar HDL cholesterol
c.
Terbentuknya small dense
LDL yang lebih bersifat aterogenik.
Peningkatan
kadar VLDL, trigliserida dan small dense LDL
serta penurunan kadar kolesterol HDL yang bersifat anti-aterogenik, anti oksidan dan
anti inflamasi akan mengurangi cadangan
anti oksidan alamiah. Lipoprotein mempunyai fungsi mengangkut lipid ke seluruh tubuh, dimana LDL terutama berperan dalam transpor
apolipoprotein (Apo) B 100; VLDL berperan dalam transpor trigliserida yang mengandung Apo E, sedangkan HDL berperan dalam mengangkut kembali kolesterol yang mengandung anti inflamasi dan anti oksidan alamiah yaitu Apo A. Molekul-molekul protein
dari lipoprotein ini akan mengalami modifikasi karena proses oksidasi, glikosilasi dan glikooksidasi dengan hasil akhir akan terjadi peningkatan
stress oksidatif dan terbentuknya ROS. Disamping itu modified
lipoprotein akan mengalami retensi didalam tunika intima yang memicu terjadinya aterogenesis (Watts et al, 1998).
7.
Hipertensi
Hipertensi
merupakan salah satu faktor dalam resistensi insulin/ sindrom metabolik dan
sering menyertai DM tipe 2. Pada penderita DM tipe 1 hipertensi dapat terjadi
bila sudah ditemukan tanda-tanda gangguan fungsi ginjal yang ditandai dengan mikroalbuminuri. Adanya hipertensi akan memperberat disfungsi endotel dan meningkatkan risiko penyakit kardiovaskuler. Hipertensi
disertai dengan peningkatan stress
oksidatif dan aktivitas Spesies Oksigen Radikal, yang selanjutnya akan
memediasi terjadinya kerusakan vaskuler akibat
aktivasi Ang II dan penurunan aktivitas Super
Oxide Dismutase. Sebaliknya
glukotoksisitas akan menyebabkan peningkatan aktivitas RAAS sehingga akan meningkatkan risiko
terjadinya hipertensi. Penelitian terbaru mendapatkan adanya peningkatan
kadar amilin (hiperamilinemia) pada individu yang mempunyai riwayat keluarga hipertensi dan
dengan resistensi insulin (McFarlane et al, 1999)
2.5 Advance
Glycation End Products (AGEs)
AGEs pertama kali diidentifikasi pada makanan yang
dimasak sebagai produk akhir dari reaksi non-enzimatik antara gula dan protein
yang disebut reaksi Maillard. Sejak adanya
penemuan bahwa reaksi ini juga terjadi didalam tubuh, maka AGEs memainkan peran
dalam patofisiologi dalam berbagai penyakit. AGEs terakumulasi dalam tubuh
manusia seiring dengan peningkatan usia. Serta AGEs meningkat secara signifikan
pada penderita DM.
Tahap
awal reaksi Maillard atau yang dikenal juga dengan glycation
yaitu glukosa bereaksi dengan kelompok protein amino (NH2)
membentuk schiff-base (Gambar 4 dan
Gambar 5). Reaksi ini terjadi cepat dan reversibel, tergantung pada konsentrasi
subtrat. Schiff-base kemudian
mengkonversi menjadi ketoamine yang disebut produk amadori yang lebih stabil (misalnya HbA1c). Gugus karbonil
reaktif bebas dari produk amadori ini yang bertanggung
jawab untuk beberapa konsekuensi biologis glikasi. Selain itu, produk amadori
dapat didegradasi menjadi berbagai senyawa karbonil lainnya yang sangat reaktif
seperti 3-deoxy-glucosone yang dapat
bereaksi lagi dengan kelompok amino bebas untuk membentuk produk intermediate glycation dimana produk intermediate ini berkontribusi terhadap
pembentukan AGEs meliputi dicarbonyl
intermediates seperti 3-deoxy-glucosone,
glyoxal dan methyl-glyoxal. Glyoxal dan methyl-glyoxal dapat dibentuk oleh glucose autooxidation dan produk glikolipid. Produk-produk glikasi
awal dan intermediate perlahan
menjalani serangkaian kompleks penyusunan ulang kimia lebih lanjut, untuk
menghasilkan senyawa AGEs yang stabil dan irreversibel, dengan kecenderungan
untuk memicu ROS dan berinteraksi dengan struktur permukaan sel tertentu. AGEs
terdiri dari sejumlah besar struktur kimia termasuk 2-(2-furoyl)-4(5)-furanyl- 1H-imidazole (FFI),
1-alkyl-2-formyl-3,4-diglycosyl pyrroles (AFGPs), N-q-carboxy-methyl-lysine
(CML), pyrraline dan pentosidine. Studi biokimia dan
imunohistokimia menunjukkan bahwa CML merupakan AGEs utama yang terakumulasi in vivo (Basta et al.,2004; Huebschmann
et al., 2006; J.W.L. Hartog et al, 2007; Ryoji et al, 2012).
Gambar 4. Waktu dalam proses Reaksi Maillard (dikutip
dari J.W.L. Hartog et al, 2007).
Fraksi baru dari total AGEs dengan efek yang relevan
tidak hanya pada struktur dan fungsi protein namun juga sebagai mediator respon
biologis telah ditandai dlam jaringan. Senyawa ini meliputi (1) imidazolone
yang dibentuk oleh reaksi 3-deoxy-glucosone
dan residu arginine dalam protein,(2) N-ε-carboxyethyl-lysine, sebuah analog
CML yang dibentuk oleh reaksi dari methyl-glyoxal
dengan lysine,(3) glyoxal-lysine dimer
(GOLD), (4) methyl-glyoxal-lysine dimer
(MOLD), merupakan imidazolium cross-links
yang dibentuk oleh reaksi glyoxal atau methyl-glyoxal dengan residu lysine dalam
protein. Selain itu, adanya myeloperoxidase sel darah putih dapat
meningkatkan pembentukan glycolaldehyde dan 2-hydroxy-propanal dari serine dan threonine, bahkan tanpa adanya
gula, menunjukkan peran AGEs dalam inflamasi (Basta et al.,2004).
Gambar 5. Pathway pada pembentukan advanced glycation end products (AGEs) (dikutip dari Basta et al., 2004)
Mekanisne
alternatif pembentukan AGEs termasuk carbonyl stress pathway dimana
oksidasi dari gula dan atau lemak membentuk senyawa dicarbonyl intermediate yang
menggunakan grup karbonil reaktif untuk berikatan dengan
asam amino dan terbentuk AGEs (Gambar 6).
Mekanisme yang lain adalah melalui aldose reductase–mediated polyol pathway (Huebschmann
et al., 2006).
Gambar 6. Mekanisme pembentukan AGEs (dikutip dari
Huebschmann et al., 2006).
Advanced glycation end products membuat
kerusakan pada sel melalui jalur dari reseptor AGEs
(RAGE) dan melalui reactive oxygen species (ROS) intrasel serta proses
timbal balik AGEs dengan ROS yang akan menghasilkan salah
satu dari keduanya (Gambar 7). ROS
mengaktifkan signaling pathway berupa mitogen-activated protein
kinase (MAPK), protein kinase C (PKC), Janus kinase/signal
transducer (JAK/STAT) dan aktivator dari transkripsi, yang berefek pada
pengeluaran sitokin proinflamasi dan profibrotik (Uribarri dan Tuttle , 2006).
Gambar 7. Jalur
kerusakan sel akibat AGE (dikutip dari Uribarri dan Tuttle , 2006).
2.6 Cara AGEs Mendorong
Terjadinya Aterosklerosis
Pada pasien DM tipe 2 dengan penyakit jantung koroner terjadi
peningkatan AGEs dan CML. Analisa imunohistokimia dari lesi aterosklerosis pada
manusia dengan menggunakan antibodi monoklonal anti-AGE telah menunjukkan
diposis AGEs secara difuse baik ekstraseluler maupun intraseluler pada makrofag
dan sel otot polos pembuluh darah. Konsentrasi AGEs berkorelasi dengan tingkat
keparahan lesi ateroskeloris dan juga dengan akumulasi protein plasma,
lipoprotein dan lipid pada dinding pembuluh darah (Basta et al.,2004).
AGEs dapat sangat merugikan bagi integritas dan fungsi
dinding pembuluh darah dalam beberapa cara. Salah satu kemungkinannya yaitu
murni pada disfungsi mekanis akibat jembatan silang yang dibentuk oleh AGEs
dengan makromolekul dinding pembuluh darah. Kedua, akumulasi AGEs dapat
menyebabkan sirkulasi adhere dinding
pembuluh darah. Ketiga, kerusakan nonmekanis akibat gangguan fungsi selular
melalui ikatan berbagai reseptor yang telah diidentifikasi pada berbagai tipe
sel, termasuk makrofag, sel endotel, sel otot polos, sel ginjal dan saraf. AGEs
dapat mempercepat proses aterosklerosis melalui dua mekanisme umum yang dapat
diklasifikasikan sebagai non-receptor-dependent
(Tabel 2) dan receptor- mediated (Tabel
3) (Basta
et al.,2004).
Tabel 2. Efek
Non-receptor-mediated dari AGEs pada Aterogenesis (dikutip dari Basta et al.,2004)
|
Extracellular matrix
Collagen cross-linking and high resistance to
collagenases
Enhanced synthesis of extracellular matrix components
Decreased polymer self-assembly of laminin and
impairment of binding to
type-IV
collagen, and heparan sulfate proteoglycans
Quenching of nitric oxide by collagen-linked AGEs
Trapping of LDL and IgG in the subendothelium
Lipoprotein modifications
Reduced AGE–LDL recognition by cellular LDL receptor
Increased LDL susceptibility to oxidative modifications
|
Tabel 3. Efek
Receptor-mediated dari AGEs pada Aterogenesis (dikutip dari Basta et al.,2004)
|
Mononuclear phagocytes
Induction of PDGF, IGF-1, IL-1 ß and TNF-α
Chemotaxis by soluble AGEs
Apoptaxis by immobilized AGEs
Increased macrophage uptake of AGE–LDL
Smooth muscle cells
Increased proliferative activity
Increased production of fibronectin
Endothelial cells
Increased permeability
Increased intracellular oxidative stress
Induction of endothelin-1 and increased
vasoconstriction
Reduction of thrombomodulin expression and induction of
tissue factor
expression
Increased expression of adhesion molecules
|
Gambar 8. Efek AGEs melalui aktivitasi RAGE (dikutip dari
J.W.L. Hartog et al, 2007).
2.7 Resptor Advance
Glycation End Products (RAGE)
Pada saat ini reseptor sel permukaan yang mengenali AGEs yaitu RAGE, macrophage scavenger receptor class A
(SR-A), SR-B (SR-B1 and CD36), lectin-like
oxidized low density lipoprotein receptor-1 (LOX-1), galectin-3 complex, fasciclin
, epidermal growth factor (EGF)-like,
laminin-type EGF-like dan link domain-containing scavenger receptors-1
and -2 (FEEL-1 and -2), megalin, serta toll-like
receptor 4 (TLR4) (Gambar 9).
RAGE dan TLR4 keduanya diyakini sebagai reseptor yang
bertanggung jawab untuk transduksi sinyal intraseluler. RAGE adalah tipe 1
protein transmembran yang termasuk dalam super famili immunoglobulin, dimana
RAGE merupakan reseptor multiligand yang tidak hanya mengenali AGEs tetapi juga
advanced oxidation protein products
(AOPPs) akibat stress oksidatif, amyloid beta yang berhubungan dengan penyakit Alzheimer,
highmobility group box-1 (HMGB-1) yang terkait dengan metastase kanker dan
inflamasi, mediator inflamasi protein S100 yang disekresi oleh sel-sel imun, Mac1/CD11b
pada sel permukaan dari sel darah putih,
lipopolisakarida dari komponen membran bakteri, complement C3a, dan phosphatidylserine pada sel apoptosis (Ryoji,
2012).
Sebuah jalur
sinyal intraseslular yang khas untuk RAGE adalah melibatkan pembentukan stres
oksidasi intraseluler dan aktivasi faktor
transkripsi NFκB (Ryoji, 2012. RAGE secara fungsional terlibat dalam perkembangan komplikasi vaskuler pada
diabetes terbukti pada penelitian terhadap tikus transgenik diabetes terjadi
ekspresi yang berlebihan dari RAGE pada sel vaskular yang telah menunjukkan
adanya percepatan diabetes nefropati pada tikus model ini. Dan pada model tikus
diabetes dengan gen RAGE yang dirusak menunjukkan hasil nefropati yang
diperbaiki (Myint
et al, 2006).
Gambar 9. Reseptor AGEs
(dikutip dari Ryoji, 2012)
BAB III
KESIMPULAN
Aterosklerosis
merupakan respon peradangan kronis terhadap kerusakan pembuluh darah akibat
berbagai sebab yang mengaktivasi atau merusak endotel dimana terjadi penebalan dan pengerasan arteri akibat terbentuknya
plak yang tersusun dari sekumpulan lipoprotein, matriks ekstrasel seperti
kolagen, proteoglikan dan glikosaminoglikan, kalsium, sel-sel otot polos,
pembuluh darah baru, sel-sel radang terutama makrofag,
limfosit T, mastosit dan sel dendritik
Pada
diabetes mellitus tipe 2 terjadi pembentukan
aerosklerosis yang cepat, diduga karena adanya pembentukan
dan deposisi molekul advanced glycation
end products (AGEs) yang merupakan hasil dari glikasi protein dan glukosa atau lipid akibat peningkatan kadar glukosa
darah. AGEs dapat mempercepat proses aterosklerosis melalui dua
mekanisme umum yang dapat diklasifikasikan sebagai non-receptor-dependent dan receptor- mediated.
AGEs dapat mengubah homeostasis dinding pembuluh darah
secara proaterogenik melalui beberapa mekanisme: perubahan permeabilitas
matriks ekstraseluler, pelepasan sitokin inflamasi dan faktor pertumbuhan,
perubahan sifat antitrombik endothelium serta peningkatan ekspresi molekul
adhesi dan kemokin pada sel vaskular. Sekali dimulai, maka proses peradangan
kronis ini akan terjadi pada pembuluh darah dimana terdapat migrasi dan
aktivasi sel-sel inflamasi yang sebagian besar adalah mononuklear fagosit dan T
sel yang menginfiltrasi ke dinding pembuluh darah. Proses ini akan memicu
terus-menerus siklus cideranya sell dan disfungsi endothel sebagian melalui
ligand RAGE.
Reseptor AGE (RAGE) diekspresikan
pada berbagai organ dan sel, termasuk sel endotel, sel otot polos vaskuler dan
makrofag. Ikatan AGEs pada RAGE memicu pembentukan reactive oxygen species (ROS)
intraseluler, yang selanjutnya akan mengaktivasi NF-κB, sehingga ekspresi
berbagi sitokin juga akan meningkat, meliputi tumour necrosis factors (TNF-α
dan TNF-β), interleukins (IL) 1, 6, 8 dan18 dan interferon-γ
DAFTAR PUSTAKA
- American Diabetes Association. 2012. Standards of Medical Care in Diabetes 2012. Diabetes Care, Volume 35, Supplement 1, 2012
- Albertini,JP, Valensi,P, Lormeau,B, Aurousseau, MH, Ferriere, F, Attal, JR, dkk. Elevated concentration of soluble E-Selectin and Vascular Cell Adhesion Molecule-1 in NIDDM. Diabetes Care J 2008:21(6);1008-12.
- Basta et al. 2004. Advanced Glycation End Products and Vascular Inflammation: Implications for Accelerated AtherosclerosisiIn Diabetes. Cardiovascular Research 63 : 582– 592.
- Beckman JA, Libby P, Creager MA, 2012. Diabetes Mellitus, the Metabolic Syndrome, and Atherosclerotic Vascular Disease. In: Libby P, Bonow RO, Mann DL, Zipes DP (eds). BRAUNWALD'S Heart Disease A Textbook of Cardiovascular Medicine, 9th ed.
- Cefalu, W.T. 2006. Cardiovascular Disease in Type 2 Diabetes: From Research to Clinical Practice. www.medscape.org (Online). Diakses tanggal 20 Oktober 2012.
- Falk, E. 2012. Atherothrombosis: Role of Inflammation: Introduction dalam Hurst’s The Heart 13th edition. New York: Mc Graw-Hill company.
- Feener EP and Dzau VJ, 2006. Pathogenesis of Cardiovascular Disease in Diabetes. In Kahn CR, Weir GC, King GL, Jacobson AM, Moses AC, Smith RJ,(eds). Joslin’s Diabetes Mellitus,14th ed
- Hansson GK. 2005. Inflammation, Atherosclerosis, and Coronary Artery Disease. N Engl J Med 352:1685–1695
- Hayat et al. Diabetic Cardiomyopathy: Mechanisms, Diagnosis and Treatment. Clinical Science 2004; 107, 539–557
- Hayden et al. "A" is for Amylin and Amyloid in Type 2 Diabetes Mellitus. J Pancreas. 2001; 2:124-39. www.joplink.net (Online). Diakses tanggal 19 Oktober 2012.
- Huebschmann AG, Regensteiner JG, Vlassara H, Reusch JEB, 2006. Diabetes and Advanced Glycoxidation End Products. Diabetes Care, 29: 1420
- Jialal et al. Characterization of the Receptors for Insulin and the Insulin-Like Growth Factors on Micro- and Macrovascular Tissues. Endocrinology 1985;117:1222
- Jiang et al. Characterization of Selective Resistance to Insulin Signaling In the Vasculature of Obese Zucker Rats. JClin Invest 1999;104:447
- J.W.L. Hartog et al. Advanced Glycation End-Products (AGEs) and Heart Failure: Pathophysiology and Clinical Implications. European Journal of Heart Failure 9. 2007;1146
- Klein L. Textbook of Cardiovascular Medicine, 3rd Edition (ed) dalam E.J Topol. 2007. Ohio: Lippincott Williams &
- Libby P. 2002 .Inflammation in Atherosclerosis. Nature. 420:868
- Libby, J. 2008. Harrison’s Principles of Internal Medicine 17th edition (eds) dalam A.S Fauci (et al). New York: Mc Graw-Hill
- Makimattila et al. Chronic Hyperglycemia Impairs Endothelial Function and Insulin Sensitivity via Different Mechanisms in Insulin-Dependent Diabetes Mellitus. Circulation 1996; 94:1276
- Maroon, D.J et al. 2012. Hurst’s: the Heart 13th ed. (eds) dalam V. Fuster (et all). Mc Graw-Hill
- McFarlane et al. Angiotensin Converting Enzyme Inhibition and Arterial Endothelial Function in Adults With Type 1 Diabetes Mellitus. DiabetMed 1999; 16:62
- Myint et al: RAGE control of diabetic nephropathy in a mouse model: effects of RAGE gene disruption and administration of low-molecular weight heparin. Diabetes. 2006;55(9):2510
- Nilsson J, Hansson GK, Shah PK. 2005. Immunomodulation of Atherosclerosis:Implications for Vaccine Development. Arterioscler Thromb Vasc Biol 25:18
- Node, K dan Inoue T. Post Prandial Hyperglycemia as an Etiological Factor in Vascular Failure. 2009. Cardiovascular Diabetology 2009. www.cardiab.com. (Online). Diakses tanggal 20 Oktober 2012
- Nordt et al. Augmentation of Synthesis of Plasminogen Activator Inhibitor Type-1 in Arterial Endothelial Cells by Glucose and Its Implications for Local Fibrinolysis. Arterioscler Thromb 1993;13:1822–1828.
- PERKENI. 2011. Konsensus Pengelolahan dan Pencegahan Diabetes Melitus Tipe 2 di Indonesia 2011. Jakarta. PB PERKENI.
- Rudd, J.H.F, J.R Davies, dan Peter L. Weissberg. 2007. Textbook of Cardiovascular Medicine, 3rd Edition (eds) dalam E.J Topol. Ohio: Lippincott Williams & Wilkin
- Ryoji et al. Advanced Glycation End Products and Their Receptors as Risk Factors for Aging. Anti-Aging Medicine 9 (4) 2012:108-113. Song et al. Circulating Levels of Endothelial Adhesion Molecules and Risk of Diabetes in an Ethnically Diverse Cohort of Women. Am Diabetes Ass J 2007:56;1898-1905.
- Tong, P. 2010. Post-prandial Hyperglycaemia & Cardiovascular Disease: An Endocrinologist's Perspective. The Hongkong Medical Diary vol. 15 no. 1 Desember 2011. www.fmshk.org (Online). Diakses tanggal 20 Oktober 2012.
- Ungvari ZI, Orosz Z, Labinskyy N, Rivera A, Xiangmin Z, Smith KE, Csiszar A. 2007. Increased Mitochondrial H2O2 Production Promotes Endothelial NF-Kb Activation in Aged Rat Arteries. Am J Physiol Heart Circ Physiol. 293:H37–H47.
- Uribarri J and Tuttle KR, 2006. Advanced Glycation End Products and Nephrotoxicity of High-Protein Diets. Clin J Am Soc Nephrol 1: 1293–1299.
- Vuster, F. 2007. Cecil Medicine 23rd edition (eds) dalam L Goldmann (et al). Philladelphia: Saunders Elsevier
- Waller BF. Hurst’s: the Heart 13th ed. (eds) dalam V. Fuster (et all). 2010. Mc Graw-Hill company
- Watts et al. Dyslipoproteinaemia and Hyperoxidative Stress in the Pathogenesis of Endothelial DysfunctioniIn Non-Insulin Dependent Diabetes Mellitus: a Hypothesis. Atherosclerosis 1998;141:17–30.
- Wright, E, J.L Bacon dan L.C Glass. 2006. Oxidative Stress in Type 2 Diabetes: The Role of Fasting and Postprandial Glycaemia. Int J Clin Pract. 2006 March; 60(3): 308–314. www.ncbi.nlm.nih.gov (Online). Diakses tanggal 20 Oktober 2012.









1 komentar:
alhamduliah, dapat ilmu lagi, semoga bermanfaat dan berkah ya gan :)
http://obatherbal07.com/obat-herbal-aterosklerosis/
Post a Comment